| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
| Свойства атома | |||||
| Название, символ, номер | Гелий/Helium (He), 2 | ||||
| Атомная масса (молярная масса) |
4,002602(2)[1] а. е. м. (г/моль) | ||||
| Электронная конфигурация | 1s2 | ||||
| Радиус атома | ? (31)[2] пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 28[2] пм | ||||
| Радиус иона | 93[2] пм | ||||
| Электроотрицательность | 4,5 (шкала Полинга) | ||||
| Электродный потенциал | 0 | ||||
| Степени окисления | 0 | ||||
| Энергия ионизации (первый электрон) |
2361,3(24,47) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) |
0,147 г/см3 (при −270 °C); 0,00017846 (при +20 °C) г/см³ |
||||
| Температура плавления | 0,95 K (-272,2 °C, -457,96 °F) (при 2,5 МПа) | ||||
| Температура кипения | 4,2152 K (-268,94 °C, -452,08 °F) (для 4He)[3] | ||||
| Уд. теплота плавления | 0,0138 кДж/моль | ||||
| Уд. теплота испарения | 0,0829 кДж/моль | ||||
| Молярная теплоёмкость | 20,79[3] Дж/(K·моль) | ||||
| Молярный объём | 31,81 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | гексагональная | ||||
| Параметры решётки | a=3,570 Å; c=5,84 Å | ||||
| Отношение c/a | 1,633 | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) 0,152 Вт/(м·К) | ||||
| Номер CAS | 7440-59-7 | ||||
| Эмиссионный спектр | |||||
|
|
|||||
| 2 | Гелий |
4,0026 | |
| 1s2 | |
Ге́лий (He, лат. helium) — второй химический элемент периодической системы. Относится к 18-й группе, первому периоду системы и возглавляет группу инертных газов. Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
По распространённости во Вселенной занимает второе место после водорода и является вторым по лёгкости, также после водорода, химическим веществом. Его температура кипения — самая низкая среди всех известных веществ.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. «Фракционная дистилляция» в статье Дистилляция).
История открытия

18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелено-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов[4][5].
Спустя два месяца, 20 октября, английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно — 587,56 нм), он обозначил её D3, так как она была очень близко расположена к фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер совместно с английским химиком Эдуардом Франклендом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце»)[5].
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещенными ветвями лавра, а на другой — изображение мифологического бога света Аполлона, правящего в колеснице четверкой коней, скачущей во весь опор[5].
В 1881 году итальянец Луиджи Пальмьери опубликовал сообщение об открытии им гелия в вулканических газах фумарол. Он исследовал светло-жёлтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия. Пальмьери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Учёные круги встретили это сообщение с недоверием, так как свой опыт Пальмьери описал неясно. Спустя многие годы в составе фумарольных газов действительно были найдены небольшие количества гелия и аргона[5].
Только через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому учёному-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло[5].
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента[6][7].
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а ещё через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере[5][8][9].
Ещё до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд, однако он ошибочно полагал, что получил азот[9], и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. Но только значительно позже, в 1906 году, Резерфорд и Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия. Эти исследования положили начало современной теории строения атома[10].

Только в 1908 году нидерландскому физику Хейке Камерлинг-Оннесу удалось получить жидкий гелий. Он использовал дросселирование (см. Эффект Джоуля — Томсона), после того как газ был предварительно охлаждён в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий ещё долго оставались безуспешными даже при температуре в 0,71 K, которую достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. Лишь в 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, ему удалось выделить кристаллы[11].
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением, и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название «λ-точка»[11]. Более точное значение температуры в этой точке, установленное позднее, — 2,172 K. В λ-точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причем без выделения скрытой теплоты; имеет место фазовый переход II рода. Выше температуры λ-точки существует так называемый гелий-I, а ниже её — гелий-II[11].
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения[11][12]. Вот что он писал в одном из своих докладов про открытие этого явления[13]:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим.
… Если вязкость воды равняется 10⋅10−2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
От греч. ἥλιος — «Солнце» (см. Гелиос). Любопытен тот факт, что в названии элемента было использовано характерное для металлов окончание «-ий» (на лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»)[5]. В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3.
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе[14]. Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва[15][16], во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде, — это ядра гелия-4)[17]. Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восемнадцатой группы гелий по содержанию в земной коре занимает второе место (после аргона)[18].
Содержание гелия в атмосфере (образуется в результате распада тория, урана и их дочерних радионуклидов) — 5,27⋅10−4 % по объёму, 7,24⋅10−5 % по массе[3][9][17]. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5⋅1014 м³[3]. Гелионосные природные газы содержат, как правило, до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8—16 %[17].
Среднее содержание гелия в земном веществе — 0,003 мг/кг или 0,003 г/т[17]. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий[19]: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8—3,5 л/кг, а в торианите оно достигает 10,5 л/кг[9][17]. Этот гелий является радиогенным и содержит лишь изотоп 4
He, он образуется из альфа-частиц, излучаемых при альфа-распаде урана, тория и их дочерних радионуклидов, а также других природных альфа-активных элементов (самарий, гадолиний и т. д.).
В 2016 году норвежские и британские ученые обнаружили залежи гелия в районе озера Виктория в Танзании. По примерным оценкам экспертов, объём запасов — 1,5 млрд кубических метров[20].
Определение
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.)[3].
Физические свойства
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксичное, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4
He) наименьшая среди всех веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при абсолютном нуле. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Химические свойства
Гелий — наименее химически активный элемент 18-й группы (инертные газы) и вообще всей таблицы Менделеева[21]. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He+
2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Энергия связи молекулярного иона гелия He+
2 составляет 58 ккал/моль, равновесное межъядерное расстояние — 1,09 Å.[22]
Известно эксимерное химическое соединение гелия LiHe[23][24].
Свойства в газовой фазе
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом. При нормальных условиях плотность составляет 0,17847 кг/м³, обладает теплопроводностью 0,1437 Вт⁄(м·К) — бо́льшей, чем у всех других газов, за исключением водорода, а его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж⁄кг·К; для сравнения — для Н2 она равна 14,23 кДж⁄кг·К).

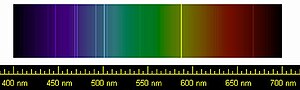
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм[11]. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных (1S0) и триплетных (3S1), поэтому в конце XIX века Локьер, Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них, по их предположению, имел в спектре жёлтую линию 587,56 нм, другой — зелёную 501,6 нм. Этот второй газ они предложили назвать астерием (Asterium) от греч. «звёздный». Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм рт. ст. наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 году[25] (см. Обменное взаимодействие). Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия, с сонаправленными спинами (с жёлтой линией в спектре) — ортогелия. Линии парагелия — одиночки, линии ортогелия — весьма узкие триплеты. Атом гелия в нормальных условиях находится в одиночном (синглетном) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ. Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного. Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения[26]. В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно, и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа: один электрон находится на 1s-орбитали, а второй — на более удалённой от ядра 2s-орбитали (состояние оболочки 1s2s). У парагелия оба электрона находятся в 1s-состоянии (состояние оболочки 1s2).
Спонтанный интеркомбинационный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом.
В бесстолкновительной среде (например, в межзвёздном газе) спонтанный переход из нижнего состояния ортогелия 23S1 в основное состояние парагелия 10S1 возможен путём излучения одновременно двух фотонов или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 23S1 → 10S1 + 2γ составляет 2,49⋅108 с, или 7,9 года[27]. Первые теоретические оценки[28] показывали[29], что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых гелиеподобных ионов в спектрах солнечной короны[30], было обнаружено[31], что однофотонный магнитно-дипольный распад 23S1-состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8⋅103 с[32].
Следует отметить, что время жизни первого возбуждённого состояния атома парагелия 20S1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 20S1 → 10S1 + γ[33], а для двухфотонного распада время жизни составляет 19,5 мс[27].
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 мл/л (15 °C), 3,2 мл/л (25 °C).
Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается при дросселировании через пористые перегородки или маленькие отверстия но и как и все газы охлаждается при любой температуры при адиабатическом расширении. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает в процессе дросселирования.
После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
В 1908 году Х. Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 K (В. Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-4 при температуре 2,17 K; он назвал фазы гелий-I и гелий-II (ниже 2,17 K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия (т. н. эффект суперсолид) при исследовании его в торсионном осцилляторе, однако многие исследователи сходятся во мнении, что обнаруженный в 2004 году эффект не имеет ничего общего со сверхтекучестью кристалла. В настоящее время продолжаются многочисленные экспериментальные и теоретические исследования, целью которых является понимание истинной природы данного явления.
Изотопы
Природный гелий состоит из двух стабильных изотопов: 4
He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3
He (0,00014 %; содержание гелия-3 в разных природных источниках может варьироваться в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Получение
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Охлаждение производят дросселированием в несколько стадий, очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода.
Эту смесь, так называемый сырой гелий (70—90 % гелия по объёму) очищают от водорода (4—5 %) с помощью CuO при 650—800 К.
Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активированном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % гелия по объёму) и высокой чистоты (99,985 %).
В России газообразный гелий получают из природного и нефтяного газов. В настоящее время гелий извлекается на гелиевом заводе ООО «Газпром добыча Оренбург»[34] в Оренбурге из газа с низким содержанием гелия (до 0,055 % об.), поэтому российский гелий имеет высокую себестоимость. Актуальной проблемой является освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири с высоким содержанием гелия (0,15—1 % об.), что позволит намного снизить его себестоимость.
Мировые запасы гелия составляют 45,6 млрд м³. В 2003 году производство гелия в мире составило 110 млн м³, в том числе в США — 87 млн м³, Алжире — 16 млн м³, России — более 6 млн м³, Польше — около 1 млн м³[35].
Транспортировка

Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды Дьюара типа СТГ-10, СТГ-25 и т. п. светло-серого цвета объёмом 10, 25, 40, 250 и 500 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение
Гелий широко используется в промышленности и народном хозяйстве:
- в металлургии в качестве защитного инертного газа для выплавки чистых металлов[источник не указан 2479 дней];
- в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
- в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
- для наполнения воздухоплавающих судов (дирижабли и аэростаты) — при незначительной по сравнению с водородом потере в подъёмной силе гелий в силу негорючести абсолютно безопасен;
- в дыхательных смесях для глубоководного погружения (см. Баллон для дайвинга);
- для наполнения воздушных шариков и оболочек метеорологических зондов;
- для заполнения газоразрядных трубок;
- в качестве теплоносителя в некоторых типах ядерных реакторов;
- в качестве носителя в газовой хроматографии;
- для поиска утечек в трубопроводах и котлах (см. Гелиевый течеискатель);
- как компонент рабочего тела в гелий-неоновых лазерах;
- в качестве наполнителя в некоторых современных моделях накопителей на жестких магнитных дисках;
- для наполнения колб филаментных светодиодных ламп, что позволяет эффективно отводить тепло от светодиодных нитей.
Кроме того, нуклид 3
He используется как рабочее вещество газовых нейтронных детекторов, в том числе позиционно-чувствительных, в технике нейтронного рассеяния в качестве поляризатора. Гелий-3 является также перспективным топливом для термоядерной энергетики. Растворение гелия-3 в гелии-4 используется для получения сверхнизких температур.
В геологии
Гелий — удобный индикатор для геологов. При помощи гелиевой съёмки[36] можно определять на поверхности Земли расположение глубинных разломов. Гелий как продукт распада радиоактивных элементов, насыщающих верхний слой земной коры, просачивается по трещинам, поднимается в атмосферу. Около таких трещин и особенно в местах их пересечения концентрация гелия более высокая. Это явление было впервые установлено советским геофизиком И. Н. Яницким во время поисков урановых руд. Эта закономерность используется для исследования глубинного строения Земли и поиска руд цветных и редких металлов[37].
Также гелий может использоваться для выявления геотермальных источников. Согласно опубликованным исследованиям, концентрации гелия в почвенном газе над геотермальными источниками превышает фоновые значения в 20-200 раз[38].
Повышенные концентрации гелия в почвенном газе могут указывать на наличие залежей урана[39]
Военное применение
- Первая мировая война — заправка военных дирижаблей в США и Германии.
- 1930-е — 1960-е годы — ошибочно считалось, что выделения гелия можно применять для поиска урановых руд[40]. Против этого ещё в 1911 году выступала М. Склодовская-Кюри.
- С 1950-х годов — продувка топливных баков жидкостных ракет.
В астрономии
В честь гелия назван астероид (895) Гелио, открытый в 1918 году.
Биологическая роль
Гелий, насколько это известно, не несёт какой-либо биологической функции.
Физиологическое действие
- Хотя инертные газы обладают наркозным действием, это воздействие у гелия и неона при атмосферном давлении не проявляется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[41].
- Содержание гелия в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания). Аналогичный эффект часто оказывает единоразовый вдох чистого гелия, например, из шарика с гелием. Как и при вдыхании других инертных газов, ввиду отсутствия вкуса и запаха часто происходит неожиданная потеря сознания при вдохе больших концентраций.
- При вдыхании гелия тембр голоса становится тонким, похожим на кряканье утки[42]. Более высокая, чем в воздухе, скорость звука в гелии при прочих равных условиях (например, температуре) увеличивает значение частоты резонанса голосового тракта (как ёмкости, наполненной газом).
Риски для здоровья
Вдыхание гелия может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород[43][44][45].
Стоимость
- В 2009 году цены частных компаний на газообразный гелий находились в пределах 2,5—3 долл./м³[46].
См. также
- Изотопы гелия: гелий-2 (дипротон), гелий-3, гелий-4
- Агрегатные состояния: жидкий гелий, твёрдый гелий
- Гелиеметрия — наука, изучающая прохождение гелия через различные среды.
- Гелиевая съёмка — один из методов геохимических геологоразведочных работ.
- Эффект Померанчука — аномальный характер плавления (или затвердевания) лёгкого изотопа гелия 3
He
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — DOI:10.1351/PAC-REP-13-03-02.
- 1 2 3 Size of helium in several environments (англ.). www.webelements.com. Проверено 10 июля 2009.
- 1 2 3 4 5 Соколов В. Б. Гелий // Химическая энциклопедия: в 5 т / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 513—514. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Kochhar, R. K. French astronomers in India during the 17th – 19th centuries (англ.) // Journal of the British Astronomical Association. — 1991. — Vol. 101, no. 2. — P. 95—100.
- 1 2 3 4 5 6 7 Финкельштейн Д. Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 40—46. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Langlet, N. A. (1895). “Das Atomgewicht des Heliums”. Zeitschrift für anorganische Chemie [нем.]. 10 (1): 289—292. DOI:10.1002/zaac.18950100130.
- ↑ Weaver, E. R. Bibliography of Helium Literature // Industrial & Engineering Chemistry. — 1919.
- ↑ Aaron John Ihde. Chapter 14. Inorganic chemistry I. Fundamental developments // The development of modern chemistry. — Изд. 2-е. — М.: Courier Dover Publications, 1984. — С. 373. — 851 с. — ISBN 0486642356.
- 1 2 3 4 Фастовский В.Г., Ровинский А.Е., Петровский Ю.В. Глава первая. Открытие. Происхождение. Распространенность. Применение // Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3—13. — 352 с. — 2400 экз.
- ↑ Бронштейн М. П. Солнечное вещество // Солнечное вещество; Лучи икс; Изобретатели радиотелеграфа. — М.: ТЕРРА — Книжный клуб, 2002. — 224 с. — (Мир вокруг нас). — ISBN 5-275-00531-8.
- 1 2 3 4 5 Финкельштейн Д. Н. Глава V. Гелий // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 111—128. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Капица, П. Л. Viscosity of Liquid Helium below the λ-Point (англ.) // Nature. — 1938. — Vol. 141. — P. 74.
- ↑ «Свойства жидкого гелия» (П. Л. Капица)
- ↑ Helium: geological information (англ.). www.webelements.com. Проверено 11 июля 2009.
- ↑ Хокинг С., Млодинов Л. Глава восьмая. Большой взрыв, черные дыры и эволюция Вселенной // Кратчайшая история времени. — СПб: Амфора. ТИД Амфора, 2006. — С. 79—98. — 180 с. — 5000 экз. — ISBN 5-367-00164-5.
- ↑ Вайнберг С. V. Первые три минуты // Первые три минуты: современный взгляд на происхождение Вселенной. — Изд. 2-е. — Ижевск: НИЦ «Регулярная и хаотическая динамика», 2000. — С. 105—122. — 272 с. — 1000 экз. — ISBN 5-93972-013-7.
- 1 2 3 4 5 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76—110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Abundance in Earth's crust (англ.) (недоступная ссылка). www.webelements.com. Проверено 11 июля 2009. Архивировано 23 мая 2008 года.
- ↑ Самарий, как и уран и торий, является природным альфа-радиоактивным элементом.
- ↑ Scientists Just Discovered a Massive Field of Precious Helium Gas in Africa
- ↑ Фаустовский В. Г., Ровынский А. Е. Петровский Ю.В. Инертные газы. — Изд. 2. — М.: Атомиздат, 1972. — 352 с.
- ↑ Л. Паулинг. Природа химической связи / перевод с англ. М. Е. Дяткиной, под ред. проф. Я. К. Сыркина. — М.-Л.: ГНТИ Химической литературы, 1947. — С. 262. — 440 с.
- ↑ Успехи физических наук
- ↑ Эксимерные лазеры
- ↑ W. Heisenberg, Z. Physik 39, 499 (1926).
- ↑ Фриш С. Э. Оптические спектры атомов. — М.-Л.: Издательство физико-математической литературы, 1963. — С. 69—71. — 640 с.
- 1 2 G. W. F. Drake, G. A. Victor, A. Dalgarno. Two-Photon Decay of the Singlet and Triplet Metastable States of Helium-like Ions. Phys. Rev. 180, 25-32 (1969).
- ↑ G. Breit and E. Teller, Astrophys. J. 91, 215 (1940).
- ↑ R.D.Knight. Lifetime of the Metastable 23S1 State in Stored Li+ Ions. — Ph.D.Thesis. Lawrence Berkeley Laboratory. — 1979. — 136 с.
- ↑ A.H. Gabriel and C. Jordan. Long Wavelength Satellites to the He-like Ion Resonance Lines in the Laboratory and in the Sun. Nature 221, 947 (1969).
- ↑ H.R. Griem, Spontaneous single-photon decay of 23S1 in Helium-like ions. Astrophys. J. 156, L103 (1969).
- ↑ G. Feinberg, J. Sucher. Calculation of the Decay Rate for 23S1 → 11S0 + One Photon in Helium. Phys. Rev. Lett. 26, 681—684 (1971).
- ↑ Это легко объяснимо из соображений симметрии. Как начальное, так и конечное состояние атома сферически симметричны и не имеют выделенного направления — оба электрона находятся в s-состоянии, и суммарный спиновый момент также нулевой. Излучение фотона с определённым импульсом требует нарушения этой симметрии.
- ↑ Основным поставщиком гелия являлся ОГЗ.
- ↑ Сырьевая база и перспективы развития гелиевой промышленности России и мира.
- ↑ Helium studies confirm presence of oil on the Aysky block in Russia
- ↑ Государственный реестр открытий СССР. Яницкий И. Н. Научное открытие № 68 «Закономерность распределения концентрации гелия в земной коре»
- ↑ Helium Survey, A Possible Technique For Locating Geothermal Reservoirs. Alan A. Roberts, Irving Friedman, Terrence J. Donovan, Edward H. Denton. US Geological Survey, Denver, Colorado 80225.
- ↑ Helium Soil Gas Survey of Aurora Uranium Deposit, McDermitt Caldera Complex, Oregon. G. Michael Reimer. U.S. Geological Survey, Branch of Isotope Geology, Denver, Colorado.
- ↑ Мусиченко Н. И. Закономерности распределения гелия в земной коре и их значение при поисках геохимическими методами месторождений газа, нефти и радиоактивных элементов [Текст] : (Метод. рекомендации) / Н. И. Мусиченко, В. В. Иванов ; М-во геологии СССР. Всесоюз. науч.-исслед. ин-т ядерной геофизики и геохимии «ВНИИЯГГ». — Москва : [б. и.], 1970. — 228 с., 1 л.
- ↑ Павлов Б. Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания. www.argonavt.com (15 мая 2007). Проверено 6 июля 2009. Архивировано 21 августа 2011 года.
- ↑ В. Н. Витер. Эксперименты с гелием ч.8
- ↑ Grassberger, Martin; Krauskopf, Astrid (2007). “Suicidal asphyxiation with helium: Report of three cases / Suizid mit Helium Gas: Bericht über drei Fälle”. Wiener Klinische Wochenschrift [нем. and англ.]. 119 (9—10): 323—325. DOI:10.1007/s00508-007-0785-4. PMID 17571238.
- ↑ Montgomery B.. 2 found dead under deflated balloon, Tampa Bay Times (3 июня 2006).
- ↑ Two students die after breathing helium, CBC (4 июня 2006).
- ↑ Нефтегазовая технология. Теория и практика. 2009 (4) ISSN 2070-5379.
Ссылки
| гелий в Викисловаре | |
| Гелий на Викискладе |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .

